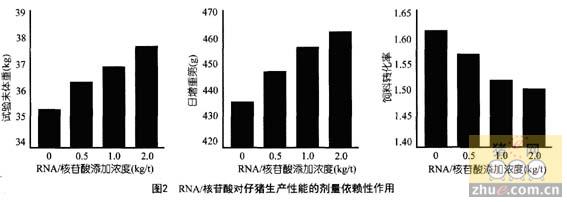
猪流感诊断方法研究进展
发布: 2013-09-29 | 作者: 王方昆 王一成等 | 来源:
猪流感(Swine influenza,SI)的病原为猪流感病毒(Swine influenza virus, SIV),属于正黏病毒科。一般呈多形态,直径约100 nm,有囊膜,囊膜上有突出的糖蛋白,通常称为纤突。纤突有2种,一种是血凝素(hemagglutinin , HA),另一种是神经氨酸酶(neuramidinase,NA)。HA和NA可作为确定流感病毒亚型和毒株的主要依据。HA在适宜条件下能凝集某些动物的红细胞,在感染的过程中与识别吸附靶细胞有关。NA既能使吸附在红细胞上的病毒脱离红细胞,也能使病毒从感染的细胞中释放出来。同种病毒的血凝素抗体可以防止病毒吸附细胞,在防止流感病毒的感染中起重要作用,而神经氨酸酶的抗体能限制病毒感染细胞。除了HA和NA这2种病毒蛋白以外,还有基质蛋白(M),核蛋白(NP),多聚酶(PA、PB1、PB2)以及非结构蛋白(NS)。
猪A型流感病毒容易在10日龄~12日龄的鸡胚尿囊腔或羊膜腔内培养,也适应原代猪胎肾,猪肺和猪气管上皮细胞,犊牛肾细胞,犬及人源细胞系,以及鸡胚成纤维细胞、犬肾细胞、猪睾丸细胞上培养。研究发现某些SIV毒株不能在鸡胚中增殖,因此只能利用细胞来增殖病毒。
仅依据临床症状和流行病学特点很难对该病做出确诊,确诊还需借助实验室诊断技术。目前,用于猪流感病原和抗体检测的方法主要有病毒的分离鉴定、血凝和血凝抑制试验、神经氨酸酶抑制试验、中和试验、琼脂凝胶扩散试验、免疫荧光法、酶联免疫吸附试验、聚合酶链式反应(PCR)、实时荧光定量PCR和NASBA(nucleic acid sequencebased amplification,NASBA)法等方法,这些方法在诊断该病中发挥重要的作用。
本文主要对近年来实验室诊断方法的进展做一综述。
1 病毒分离和鉴定
1.1 病毒的分离
对活体病例来说,一般从喉气管或鼻咽拭子经无菌处理后分离病毒;对死亡病例,肺脏和脑组织是首选病料。如果是高致病性流感病毒造成全身感染,多种组织器官中都可以分离到病毒。病毒样品如能在48 h内分离,可在4 ℃保存。如果样品要存放较长时间,则须在-75 ℃冻存。由于流感病毒能够在鸡胚中良好生长,所以一般用9日龄~11日龄的鸡胚通过羊膜腔或尿囊腔接种而分离病毒,但C型流感病毒只能在羊膜腔内增殖,初次分离时最好使用羊膜腔接种法,接种后24 h~96 h收集鸡胚尿囊液,24 h内死亡的鸡胚弃掉。用鸡的红细胞检测尿囊液或细胞培养液的血凝活性来证实病毒的增殖和存在。一般而言,如初次分离不到病毒,可盲传2代再进行检测。
1.2 病毒的鉴定
对鸡红细胞有血凝活性的鸡胚尿囊液或细胞培养液,先用新城疫病毒(Newcastle disease virse,NDV)抗血清做血凝抑制试验(haemagglutination inhibition, HI),以排除NDV的感染。然后用15种不同血凝素的特异性抗血清来做血凝抑制试验鉴定HA的亚型,用9种神经氨酸酶的特异性抗血清做神经氨酸酶抑制试验来鉴定NA亚型。
2 血清学诊断方法
血清学试验是一种传统的猪流感诊断方法,并可用于病毒抗原和抗体的检测。其特点是有较强的特异性,但敏感性大多不够高。
2.1 血凝和血凝抑制试验
流感病毒颗粒表面的HA蛋白具有识别并吸附于红细胞表面受体的结构,同时,HA蛋白的抗体与该蛋白受体的特异性结合能够干扰HA蛋白与红细胞受体的结合。基于这一原理,Duca M等[2] 在1942年建立了血凝试验(HA)和血凝抑制试验(HI)。若抗原用乙醚裂解,其敏感性比常规法高4倍~6倍,但观察结果时间限制在30 min内,否则易出现假阳性。另外,非特异凝集素和非特异抑制素影响血凝抑制试验的准确性,也是造成假阴性或假阳性的主要因素。血清中非抗体物质可能结合到血凝素上导致非特异性抑制发生和错误结果的出现,且血清中的唾液酸残基会模拟红细胞受体,同红细胞受体竞争与流感病毒血凝素结合,出现假阳性,为此,应对血清进行处理,去除非特异抑制物,常用的方法是受体破坏酶(receptor destroying enzyme, RDE)处理法和胰酶加热高碘酸盐处理法。由于位于HA分子受体结合位点内或周围的氨基酸变化可导致流感病毒对一定红细胞敏感性的丧失,因此,对一株新分离的病毒应筛选相应的红细胞用于HI试验。一般在病毒感染7 d~10 d就可以检测到抗体。该试验因其特异性好,可广泛应用于流感病毒的亚型鉴定,但若分离到的是新亚型流感病毒,用已知HA亚型的抗血清是不能检出新的HA亚型的流感病毒的,因而有一定的局限性,而且该试验周期较长,不适用于流感的早期诊断。
2.2 神经氨酸酶抑制试验
神经氨酸酶抑制试验(neuramidinase inhibition assay, NI)主要用于流感病毒的表面抗原神经氨酸酶的亚型鉴定。1983年,Van Deuson R A等对常量NI试验方法进行了改造,建立了微量NI试验方法,既降低了抗原用量,又可对多种分离物同时进行抗原分类。为此,一直被世界卫生组织推荐用于NA亚型的分类。美国国立兽医实验所已将微量NI试验方法列为流感病毒分离物定型及筛选畜禽血清亚型NA抗体的常规方法。
2.3 中和试验
用中和试验(serum neutralization test, SN)来鉴定SIV时,一般常用对病毒敏感的组织培养细胞或者鸡胚。SN是较敏感、特异的血清学方法,但只有抗体与病毒上的表面抗原相对应,特别是与吸附到宿主细胞上的病毒表面抗原相对应时,才能取得确实的试验结果。由于该试验的周期需要1周左右,而且操作繁琐,所以几乎很少用于临床进行疾病诊断。但其作为经典方法在病毒鉴定中起重要作用,许多新的检测方法都要以其为标准方法进行比较。
2.4 琼脂凝胶扩散试验
琼脂凝胶扩散试验(agar gel immunodiffusion, AGID)是在琼脂凝胶中进行的抗原抗体免疫沉淀反应。其特点是简便、快捷。由于SIV的不同亚型都具有型特异性抗原(NP蛋白),所以,可以用一种流感抗原或抗体对其所有抗体或抗原进行检测。AGID所用的抗原和抗体的其中一种必须纯化,否则,易出现假阳性结果。此外,AGID的敏感性较差。经改进的AGID免疫双扩散试验,不仅提高了敏感性,而且快速省时。在此基础上,国内已经建立了AGID诊断技术及其诊断试剂盒。倪建强等[6]采用原核表达流感病毒的核蛋白(相对保守,具有型和种属的特异性,是流感病毒型的分类和诊断的基础),通过简便易行的琼脂扩散方法可以用来对各种亚型的猪流感提供准确的诊断。SIV的检测手段中,AGID操作比较简单,结果容易判定,但其敏感性和HI试验一样偏低。将重组的核蛋白进行纯化,然后作为抗原,组装成重组NP的间接ELISA诊断试剂盒,其敏感性将会有很大的提高。
2.5 免疫荧光法
免疫荧光法(immunofluorescence assay, IFA)的基本原理是标记荧光素抗体仍能和相应的抗原形成免疫复合物,这种复合物由于有荧光素的参与,借助于荧光显微镜,能观察到细胞内病毒抗原及其存在的位置,从而得知相应的病毒抗原。早在1961年IFA就开始用于人类流感的快速诊断。此后,有很多学者用该方法检测流感病毒。IFA分为直接法和间接法,直接法是将荧光素标记在流感病毒特异性IgG抗体上,标记的抗体直接与载玻片上细胞内的流感病毒抗原结合,然后在荧光显微镜下直接显现结果,Hijazi Z等应用直接IFA对62例急性下呼吸道感染患者进行了检测,结果显示对A型流感病毒检测的特异性高达98%(与传统方法相比),但敏感性仅为62%;间接法是用标记了荧光素的抗IgG的二抗检测抗体和抗原的结合物,通过实验室应用,证实这种检测方法具有稳定、敏感、特异性强的优点。
2.6 酶联免疫吸附试验
酶联免疫吸附试验(enzymelinked immunosorbent assay,ELISA)是目前应用最广泛的病毒抗原及抗体的检测技术,已经建立了多种方法,如间接法、双抗体夹心法、捕获法和生物素亲和素法等。ELISA早在1974年就用于流感病毒的检测[9]。近年来,在传统ELISA方法的基础上,研究者们对其进一步改进并建立了膜酶免疫试验和微孔膜免疫试验。Swenson S L等[10]应用这两种方法对流感病毒进行了检测,并与鸡胚法进行了对比,两种方法的符合率达100%。Skibbe D等[11]对ELISA和HI检测猪流感抗体进行了比较研究,HI同样能检测型特异性抗原或抗体,但其敏感性远远低于ELISA法,HI试验适用于亚型的检测,其敏感性也不如ELISA。Voeten J T等[12]应用重组流感病毒核蛋白作为抗原包被ELISA板,对流感患者进行特异性IgA及IgG抗体检测,在感染后第6天,便可检出特异性的IgA,所以它可作为流感早期的血清学诊断方法之一。亢文华等[13]建立了PCRELISA方法快速检测高致病性禽流感病毒,该方法是PCR技术和ELISA技术的结合,是一种两级放大系统,即PCR放大和ELISA放大。试验证实其灵敏度己经超过鸡胚分离法(荧光PCR检出的最低稀释度为10-6.67,鸡胚分离检出的最低稀释度为10-7.67,PCR-ELISA检出的最低稀释度为10-8.80),证明本方法具有较高的敏感性,比普通PCR和荧光PCR更为快捷、简便、灵敏;同时,这种方法避免了PCR产物分析时的电泳及染色过程。ELISA法既可用于检测抗体,又可用于检测抗原,尤其适合于大批样品血清学调查。用于检测时,由于包被的抗原或抗体纯度不是很高,所以其检测结果的特异性较差。
2.7 免疫过氧化酶单层细胞试验
免疫过氧化酶单层细胞试验(immunoperoxidase monolayer assay,IPMA)用于检测猪血清中的SIV抗体。这种方法特异性强,可检测出感染后3 d的抗体,抗体效价低于100为阴性。该方法相对于HI敏感性更强,并且待检血清不需预处理,可同时检测H1N1和H3N2,而HI只能一次检测一种亚型,该方法更便于对猪群SIV抗体监测 [14]。
3 猪流感的分子生物学诊断方法
分子生物学诊断方法在SIV的监测和诊断等方面发挥着重要的作用,为快速准确的检测流感病毒提供了可靠的工具。
3.1 聚合酶链式反应
聚合酶链式反应(PCR)是一种人工体外DNA扩增技术,最早是由Mallis等于1985年建立的一种方法,并于1987年完成了自动化操作,极大地推动了分子生物学的发展,同时也为病毒性疾病的诊断提供了一个崭新的手段。在许多实验室里已广泛应用PCR方法来检测流感病毒,且检测的敏感度达到了pg水平。一些基于不同靶基因的RT-PCR检测方法在国外相继建立。Munch M等[15]建立了RT-PCR-ELISA法,该方法比RT-PCR敏感性提高100倍,并可用于隐性感染的检出。祁贤等[16]建立的套式RT-PCR法,其敏感性与RT-PCR-ELISA法相同,但比后者易于操作。部分临床样品采自无明显流感症状的猪体,经套式RT-PCR和病毒分离都为阳性,表明该法也适用于SIV隐性感染的检出。
3.2 实时荧光定量PCR
定量PCR是在PCR定性技术基础上发展起来的核酸定量技术。实时荧光定量PCR技术(real time fluorescent quantitative PCR,FQPCR)于1996年由美国Applied Biosystems公司推出,它是一种在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。该技术不仅实现了对DNA模板的定量,而且具有灵敏度高、特异性和可靠性更强、能实现多重反应、自动化程度高、无污染性、具实时性和准确性等特点,目前已广泛用于分子生物学研究和医学研究等领域。在美国,Richt J A等[17]应用Realtime RTPCR诊断和监测北美的猪流感,该方法敏感性和特异性与病毒分离相比分别达到94%和85%,而且试验可在数小时内完成;试验还指出,基于M蛋白设计引物可对SIV检测,而不需对不同的亚型设计不同的引物。Landolt G A等[18]通过试验比较指出,该方法是一种快速、准确的诊断方法,其特异性强,敏感性高,尤其适合于对大量猪流感样品的检测。
3.3 NASBA法
NASBA即核酸序列依赖的扩增,是一种扩增RNA的新技术,是由一对引物引导的、连续均一的、体外特异核苷酸序列等温扩增的酶促反应过程。反应在42 ℃进行,可以在2 h左右将模板RNA扩增约109倍,不需特殊的仪器。Lau L T等[19]将NASBA方法应用于AIV检测,整个试验过程在6 h内即可完成,其具有很高的敏感性和特异性。目前,国内还没有关于该方法应用于SIV检测,由于SIV和AIV同属A型流感病毒,NASBA在SIV检测上应用前景广阔。
4 其他诊断方法
Li J等建立了用以鉴别流感病毒型和亚型的DNA芯片检测方法,设计的26个引物对可从A型流感病毒的HA(H1、H2、H3)、NA(N1、N2)和NP基因,以及B型流感病毒的HA、NA、NP基因上的目的基因杂交,从而达到鉴别型和亚型的目的,他们认为DNA芯片的方法可以作为PCR方法的补充,但这种方法检测临床样品中的核酸序列的有效性还有待研究。
5 结语
传统SI诊断方法主要有病毒分离培养和血清学试验(如AGID、ELISA、HA、HI及SN),但这些传统的诊断方法操作繁琐,诊断时间长,结果重复性不好,特别是流感病毒的血清型众多,且新的变异株不断出现,所有这些限制了传统方法在实际中的应用,但是传统方法在病毒的初次分离和亚型鉴定中还起着重要的作用。随着分子生物学的发展,基于PCR技术的新的快速诊断方法相继建立,为快速准确的检测流感病毒提供了可靠的工具。同时,分子生物学的发展也赋予了血清学方法新的生命,如通过分子生物学的方法获得的重组蛋白为ELISA和AGID提供了新的特异性高的诊断抗原,为建立快速敏感的诊断试剂盒提供了可能。因此,随着传统诊断方法的不断改进和新技术的不断出现,SI的诊断方法必将上一个新的台阶,为控制和消灭SI提供必要的技术保障。
[1]